血液制品是以健康人血浆为原料,采用分离、纯化技术或生物工程技术制备的有生物活性的制品。由于使用的原料是人血浆,因此血液制品具有传播血源性病毒的可能性。历史上,曾因缺乏有效的病毒灭活/去除手段,导致血液制品在生产流程中遭遇严重病毒污染事件。例如,上世纪90年代中期,国外报道了因筛选试剂改变和缺乏有效的病毒灭活步骤,导致患者输注静注人免疫球蛋白(IVIG)后发生丙肝病毒(HCV)传播的事件;并且近年来还出现过热处理后的凝血因子类制品传播人细小病毒B19的事件。
因此,为了有效控制生物制品受病毒污染的风险,确保最终产品的生物安全性,国内外监管机构均出台相关法规,强制要求生物制品的生产流程必须包含能够有效灭活或去除病毒的工艺步骤。这些病毒灭活/去除技术发挥着尤为重要的作用,是血液制品安全性保障的关键环节。科百特Viruclear®系列除病毒滤器采用先进的膜技术和制造工艺,具有出色的病毒截留能力和蛋白透过率。经过严格的质量控制和性能测试,确保每一支滤器都能达到行业高标准,有效去除血液中的病毒颗粒,保障血液制品的安全性。
本文就科百特Viruclear® RC 系列除病毒滤器在凝血因子IX(F9)和四代静脉注射免疫球蛋白(IVIG)的表现案例进行分享,并进行相关工艺对比比选。
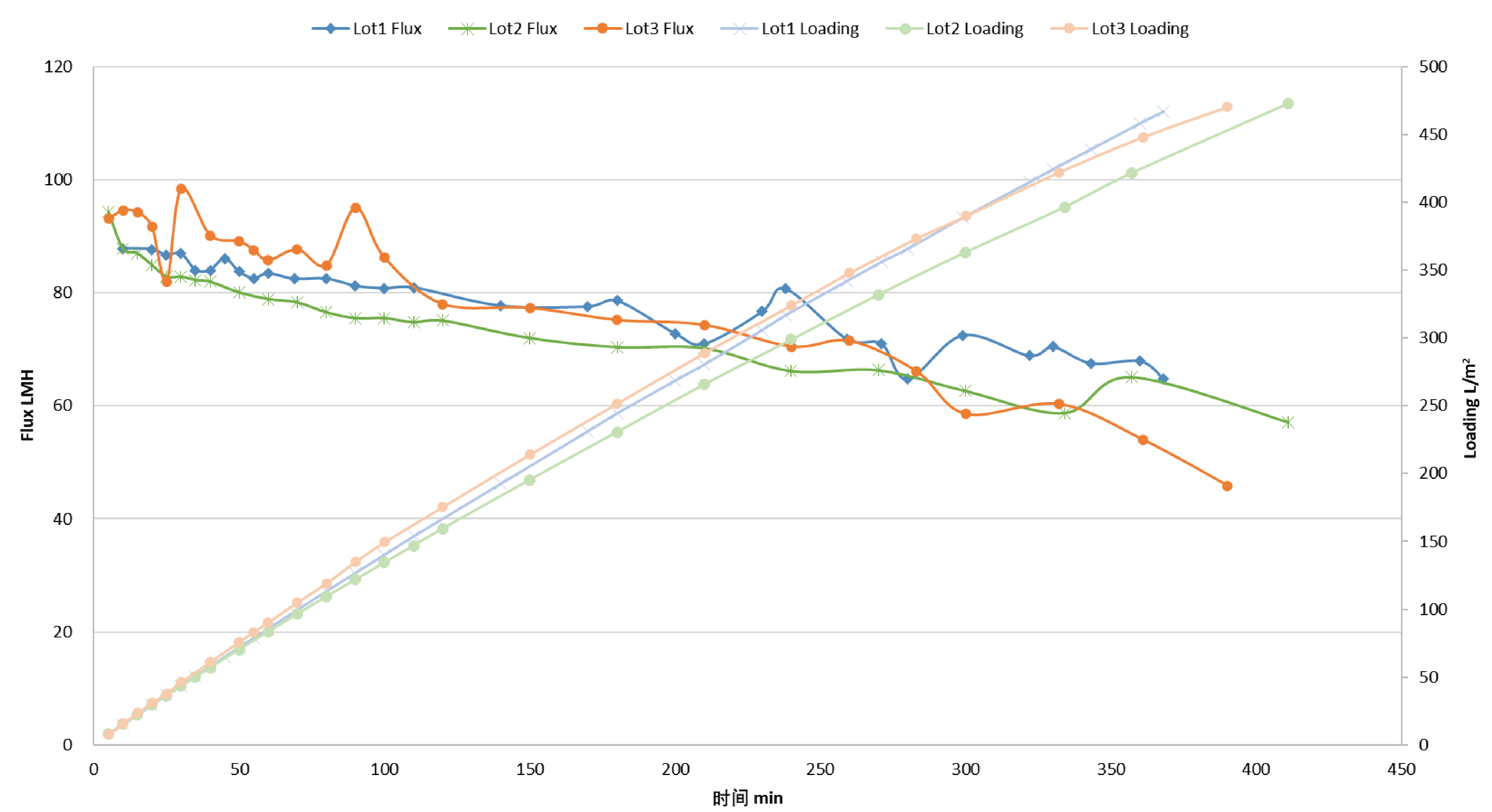
凝血因子IX除病毒过滤案例分享
测试条件:
· 浓度:1 g/L
· 三批次平行加毒测试多取样点
· 恒定压力 29.0 psi
· 采用 Corevital™ SMD 0.2/0.1 μm (除病毒预过滤) + Viruclear® RC
· 添加 4% PPV
*自验证

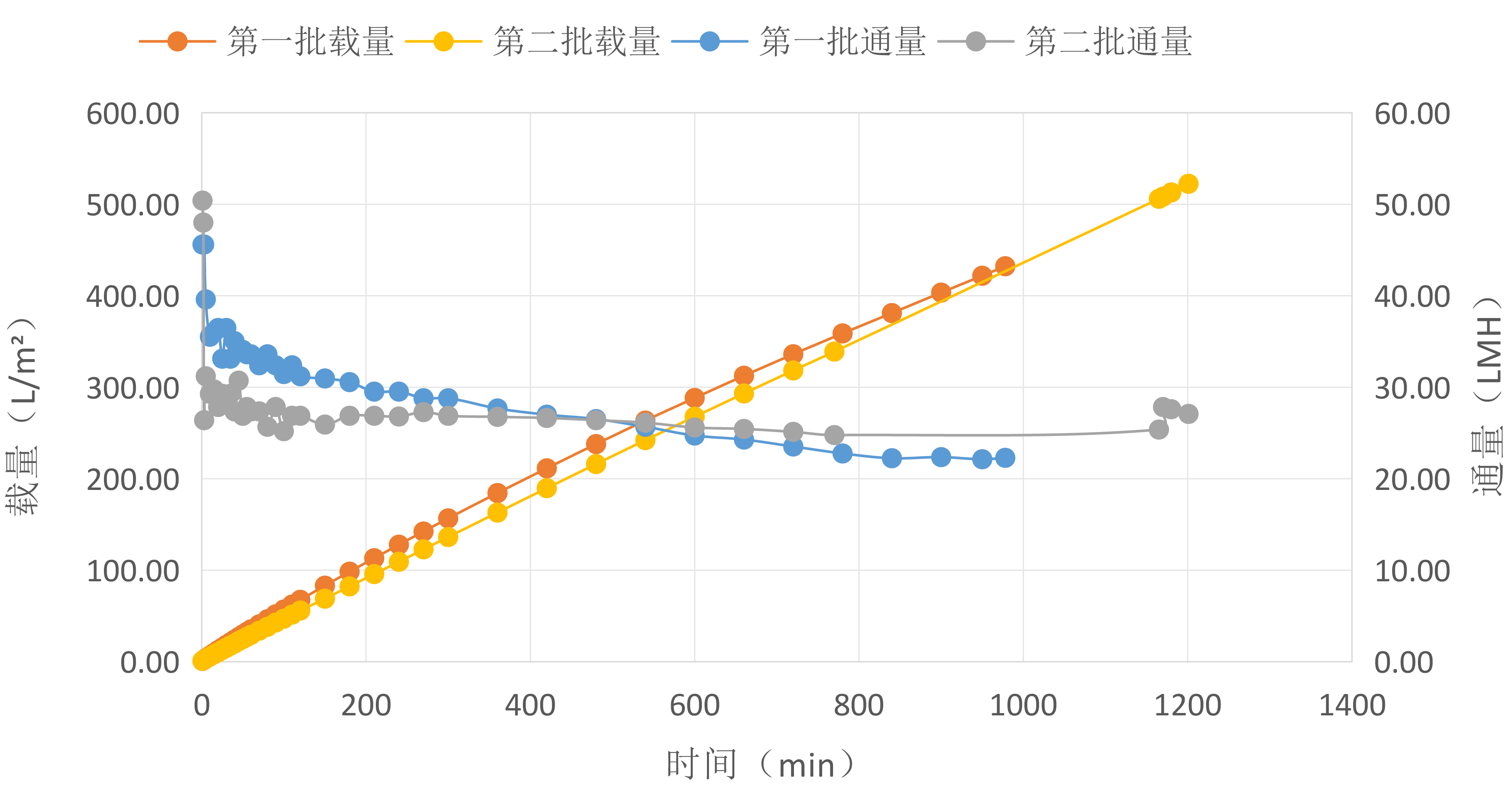
四代静脉注射免疫球蛋白( IVIG)除病毒过滤案例分享
测试条件:
· 样品:四代IVIG,41 g/L
· 恒定压力 29.0 psi,过滤16-20小时
· 采用M公司 X0HP (除病毒预过滤)+ Viruclear® RC H
*小试,未添加模型病毒
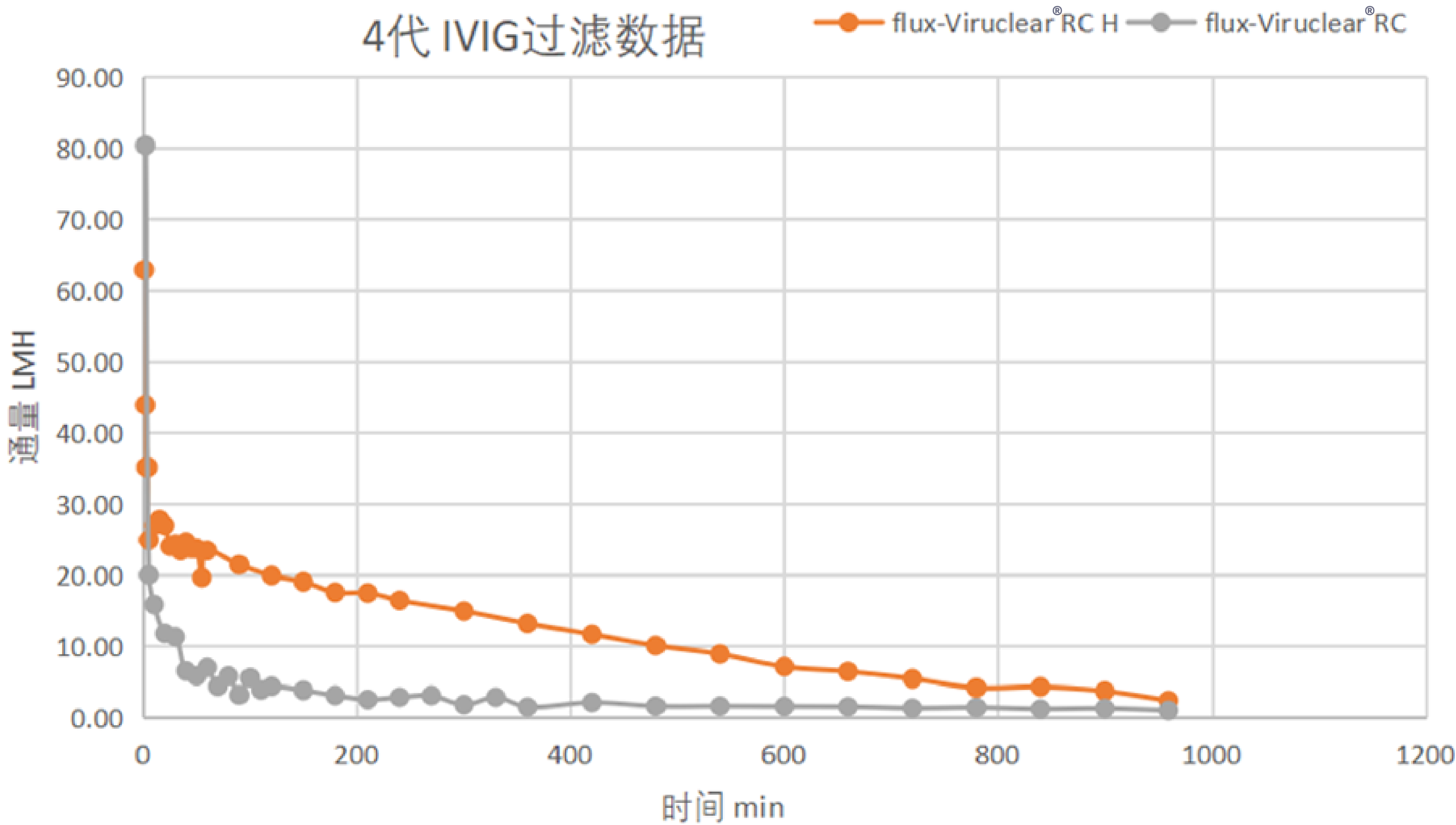
4代IVIG过滤曲线

科百特与竞品在四代IVIG的除病毒性能对比表现
头对头可滤性测试条件:
· 50 g/L 四代IVIG 中间体(Frozen-and-thawed)
· 使用 Corevital™ SMDA 0.2/0.1 μm (除病毒预过滤)
· 在供应商推荐的恒压条件下进行除病毒过滤。
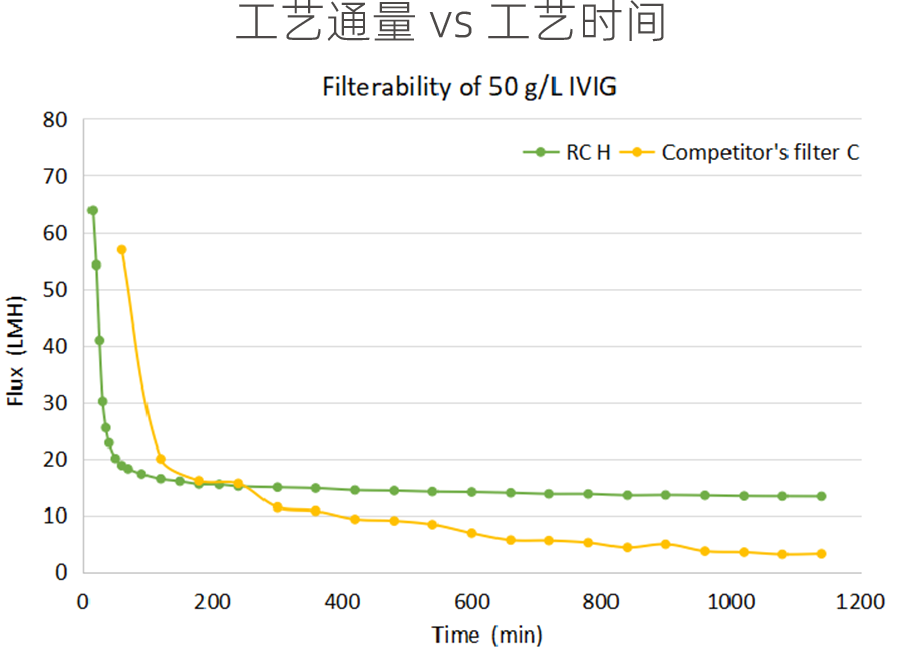
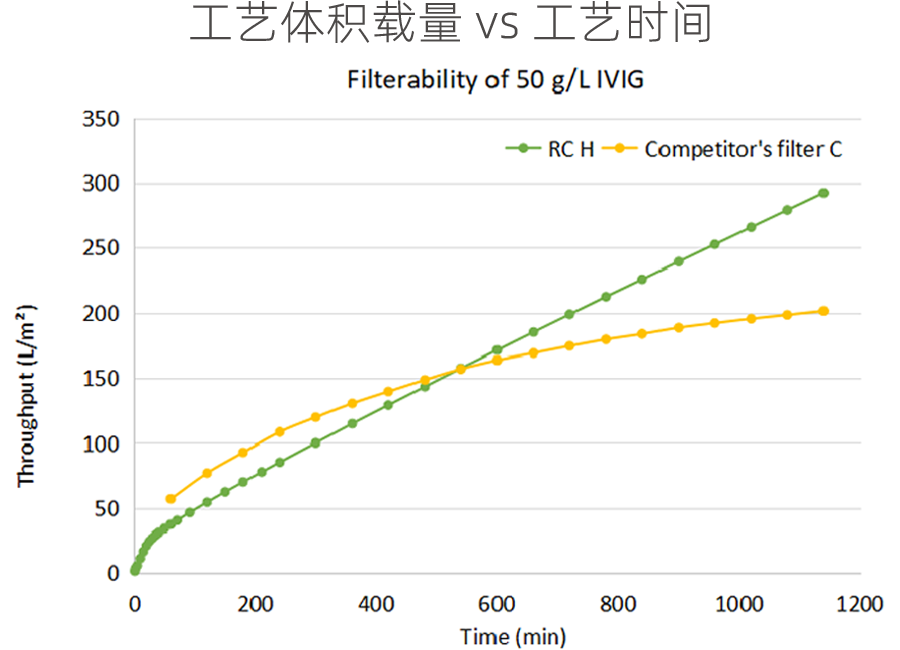
科百特除病毒过滤器Viruclear® RC和RC H系列在物料 50 g/L IVIG可滤性测试对比
· 串联Viruclear® PNY尼龙预过滤
· 恒定 30 psi 压力过滤
· 过滤16小时,Viruclear® RC H终点质量载量 8.7 kg/m2, 4倍于Viruclear® RC。
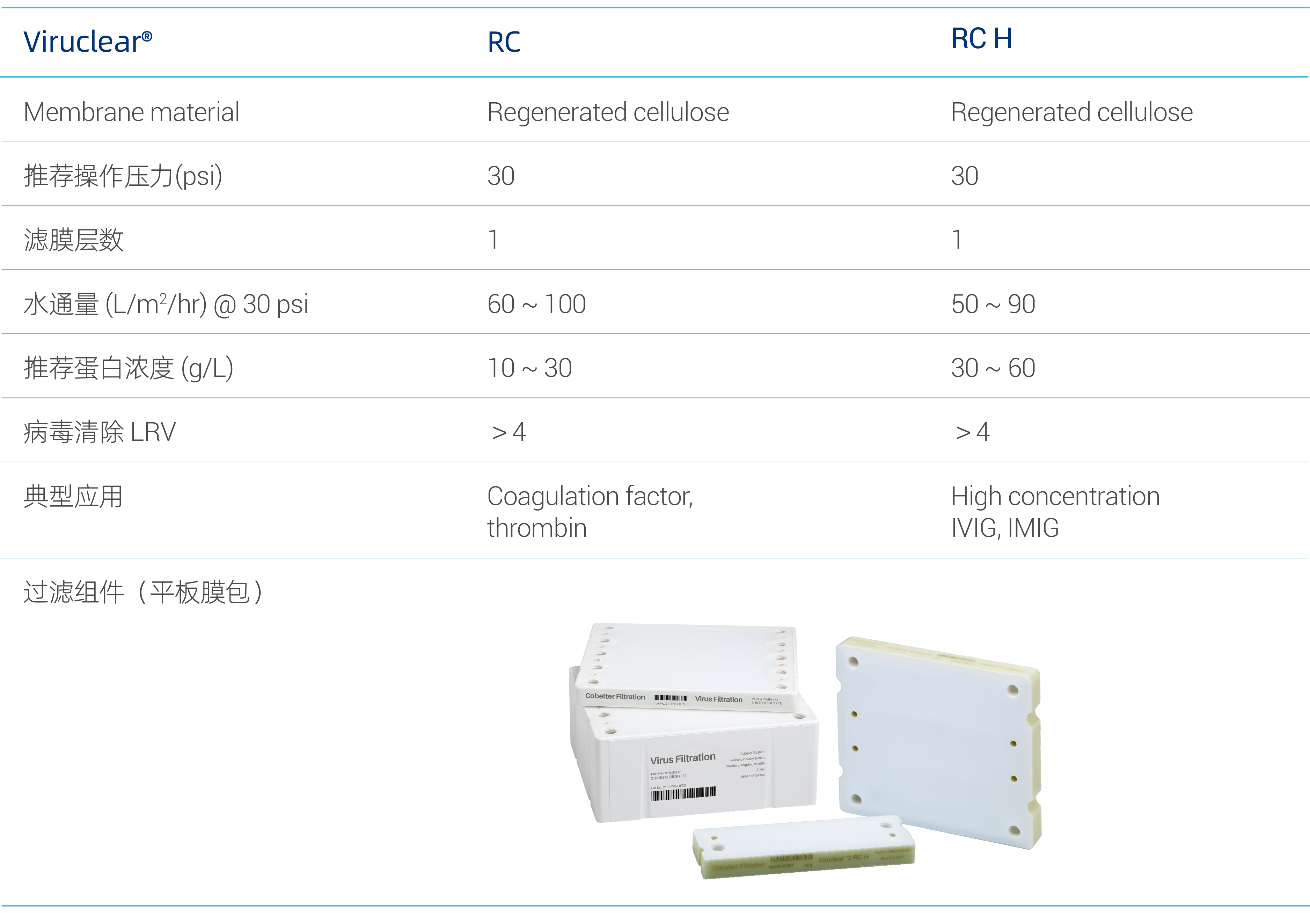
Viruclear® RC Series 除病毒过滤器参数
科百特始终致力于技术创新和产品研发,以不断满足血液制品行业对安全、高效、可靠的需求。我们期待与更多合作伙伴携手共进,共同开创血液制品行业的新篇章。




