 血液制品主要指由健康人的血浆或特异免疫人血浆采用分离纯化技术制备的生物活性制剂,包括:人血白蛋白(HA)、 球蛋白(IgG)、人凝血因子VIII、人凝血酶原复合物、人纤维蛋白原等。它是集原料药生产和制剂生产为一体的特殊剂型,其生产工艺流程核心在于通过各种分离纯化方法将上述蛋白从血浆中提取出来,包括融浆、蛋白分离、超滤、巴式灭活、除菌过滤等工序。
血液制品主要指由健康人的血浆或特异免疫人血浆采用分离纯化技术制备的生物活性制剂,包括:人血白蛋白(HA)、 球蛋白(IgG)、人凝血因子VIII、人凝血酶原复合物、人纤维蛋白原等。它是集原料药生产和制剂生产为一体的特殊剂型,其生产工艺流程核心在于通过各种分离纯化方法将上述蛋白从血浆中提取出来,包括融浆、蛋白分离、超滤、巴式灭活、除菌过滤等工序。
本文将从一次性系统的无菌保障、异物控制和减少料液残留三个方面介绍科百特一次性产品在血液制品中的应用优势。

1.一次性系统的无菌保障
一次性系统具有缩短上市时间、降低成本、减少交叉污染和提高无菌保障水平等优势。对于一次性系统的无菌保障,主要依赖于设计、生产工艺和灭菌方式的综合应用,确保整个生产过程不受污染,以达到无菌生产的要求。
 1.1 辐照灭菌验证
1.1 辐照灭菌验证
首先需要根据国际标准ISO 11137确认辐照灭菌剂量,该标准提供了针对辐照灭菌的具体验证方法和剂量设定步骤。以下是关于确认一次性系统辐照灭菌剂量的主要流程:
1)建立最大可接受剂量
建立产品的最大可接受剂量:用最大可接受剂量处理产品,且产品在规定的寿命期间内应能满足其规定的功能要求。
建立最大可接受剂量的基本技术要求应包括:
· 有评估产品预定功能的设备;
· 一个有能力实施准确剂量的合适辐射源。
2)建立灭菌剂量(剂量设定验证)
可从以下两种方法中任选其一进行建立:
· 获得并利用生物负载数量和/或抗力的信息建立灭菌剂量;
· 选择并证实15KGy 或25KGy 作为灭菌剂量能满足规定的无菌要求,使用VDmax25和VDmax15方法得到的无菌保证水平达到10-6。
建立灭菌剂量的基本技术要求应包括:
3)剂量分布验证
应按照规定的装载模式装载产品,以便:
· 确定最大与最小剂量值和位置;
· 确定最大与最小剂量和日常监测位置的剂量间的关系。
应规定产品的灭菌方式,包括:
· 对传输途径的描述(如果在辐照装置中有多个传输路径)。
剂量分布测试的记录应包括对辐照容器、装载模式、传输路径、辐照装置运行条件、剂量测量和得出的结论的描述。
4)灭菌剂量审核验证
灭菌剂量的持续有效性通过执行灭菌剂量审核监测产品上的生物负载的辐射抗力来证明。辐照灭菌剂量审核验证时间间隔一般为一个季度,以确保持续达到无菌保证水平。
1.2 无菌连接和无菌断开
在血液制品工艺中,无菌保障另一个考量重点是一次性单元之间如何实现无菌连接和无菌断开。

 在使用热塑管时,通常需要考虑热塑管的性能以及焊接性能。热塑管性能可见下表1。
在使用热塑管时,通常需要考虑热塑管的性能以及焊接性能。热塑管性能可见下表1。
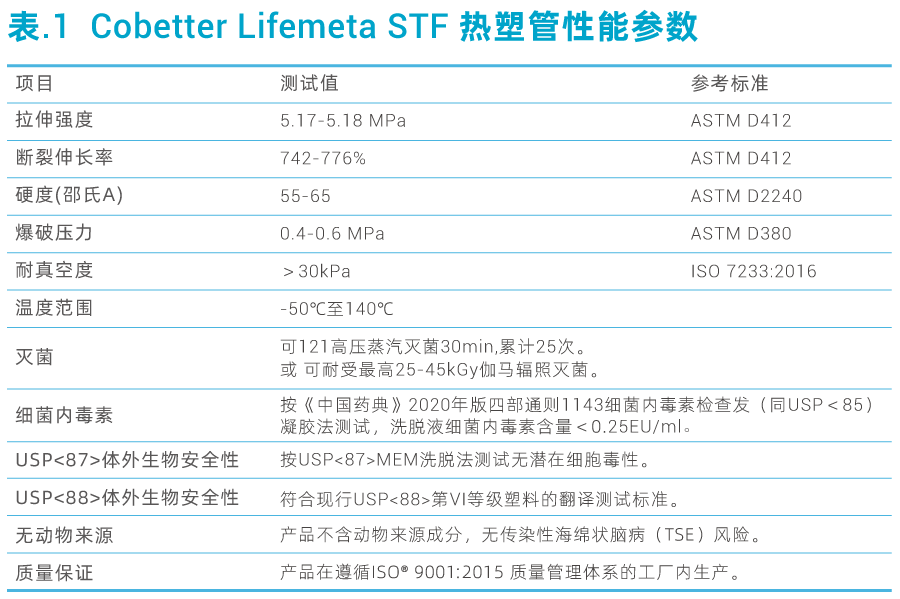
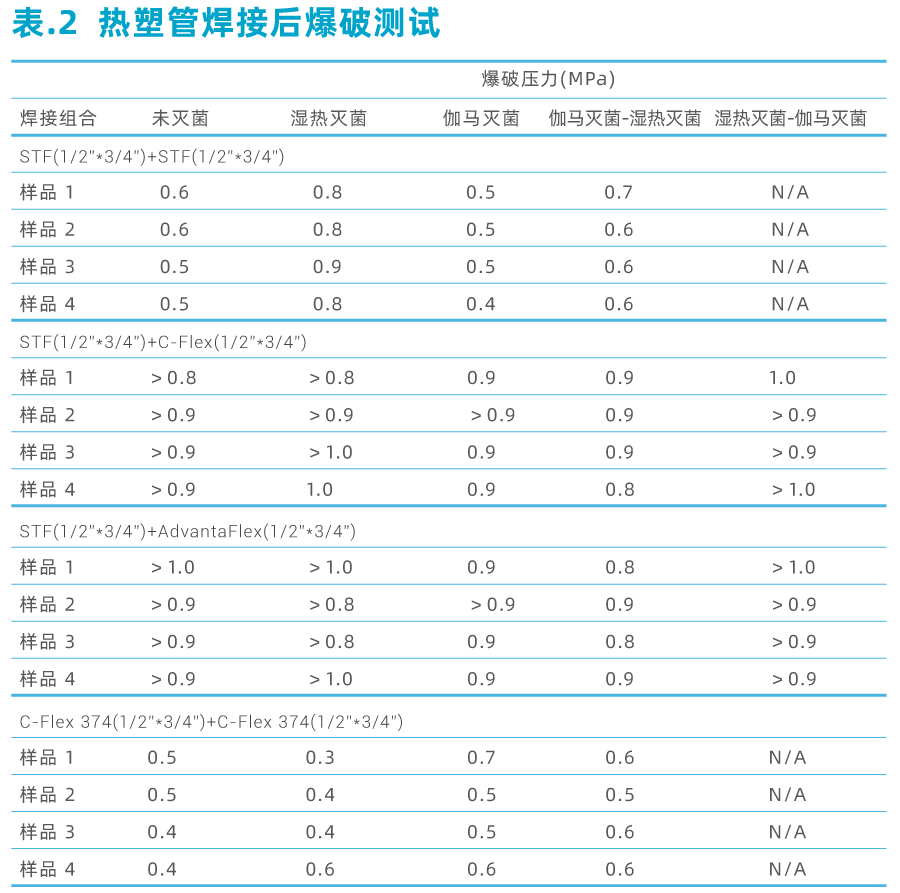
为评估其焊接性能,我们将未灭菌、25-45 kGy 伽马辐照灭菌、湿热灭菌三种条件下的科百特Lifemeta STF 热塑管(STFH150S)及其他不同品牌热塑管(C-Flex 374 热塑管、AdvantaFlex 热塑管)进行焊接后,对他们管路的耐压、抗爆和拉伸能力进行测试。
上述热塑管外观和尺寸检查无误后,分别进行25-45 kGy伽马辐照灭菌和121 ℃下1 h湿热灭菌处理。使用无菌接管设备对热塑管焊接进行组合焊接,并目视检查焊接后的样品接口处是否平整,然后进行爆破测试、耐压测试和拉伸强度测试。(篇幅有限仅展示爆破数据,如有需求请与Cobetter销售联系)
而选用一次性无菌连接组件应考虑其实现无菌连接的能力,可通过评估产品气溶胶细菌挑战试验或直接细菌挑战实验确认。例如无菌连接器、无菌断开器,在无菌生产工艺中就有大量应用,可有效地阻止微生物穿透或进入,我们可以用如下方法验证其连接无菌性保障:
· 接管机的微生物屏障验证:
验证Lifemeta Tube Welder自动无菌接管机在焊接过程中和焊接后,产品管内无菌保障能力,具体操作如下:
a.采用Lifemeta STF 和 C-Flex 374 热塑管,外观和尺寸检查无误后,使用蒸汽或辐照进行灭菌;
b.向无菌管内注入无菌胰酪大豆胨液体培养基(TSB),并用 Lifemeta Tube Sealer 手持式无菌封管机密封管路两端。在管路外壁和接管机刀片上涂上> 1x106 cfu/ml的嗜热脂肪芽孢杆菌后,使用 Lifemeta Tube Welder 自动无菌接管机进行焊接。将焊接后的样品在 55-60 ℃下培养 14 天,观察管路内的嗜热脂肪芽孢杆菌是否繁殖。
Lifemeta Tube Welder自动无菌接管机细菌挑战结果见下表3:

· 无菌断开环微生物屏障验证
将预组装的管路断开金属断开环,从断开的另外一端向供试管内注入胰酪大豆胨液体培养基(Tryptic Soy Broth, TSB),直至液体培养基液面刚好超过金属套管的上端,密封供试管。将含有 TSB 的供试管一端完全浸入含缺陷短波单胞菌的挑战培养基中,在室温下浸泡 2h。取出浸泡在含缺陷短波单胞菌的 SLB 挑战培养基中的金属套管,对其表面进行消毒,待表面完全干燥后,置在30±1 ℃ 下培养 7 天作为试验组。
无菌断开环细菌挑战结果见下表4:

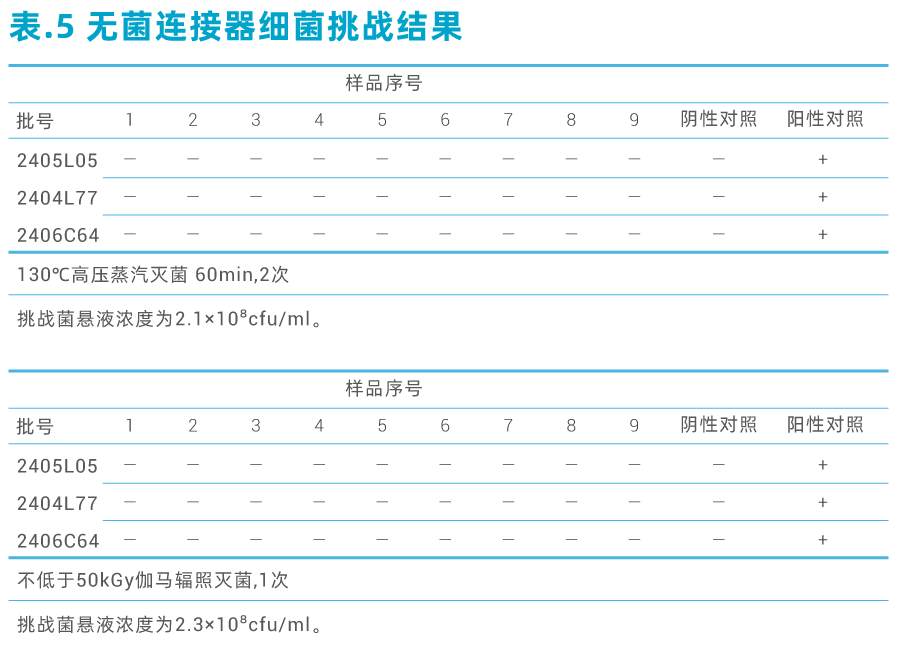
· 无菌连接器微生物屏障验证
将无菌连接器单组件的膜片蘸取缺陷短波单胞菌(Brevundimonasdiminuta,ATCC®19146),再把两个单组件连接好卡至一级,取出膜片后再卡至二级,并使连接件浸在菌液中,从组件上游注入胰酪大豆胨液体培养基(TrypticSoyBroth,TSB),下游用无菌瓶接取培养基。
无菌连接器细菌挑战结果见下表5:
1.3 一次性系统的无菌阻隔性
无菌阻隔性直接关系到产品或操作过程中的微生物污染风险,尤其是在生物制剂生产中,任何外部污染都可能导致产品失效或对患者健康产生影响。因此,确保一次性系统的无菌性至关重要。我们根据袋体生产工艺设计特定规格,对一次性袋体进行微生物挑战,具体方案及结果如下:
采用不低于50kGy伽马辐照对CobetterLifecube一次性使用储液袋进行灭菌,外观和尺寸检查无误后,在生物安全柜中,向袋内注入袋体标注体积的胰酪大豆胨液体培养基(TrypticSoyBroth,TSB)。密封袋体后完全浸入含有缺陷假单胞菌含量不低于1010cfu的SLB挑战菌悬液中,在室温下浸泡24h。取出浸泡在SLB挑战悬液中的一次性使用储液袋,置在30~35°C下培养7天,并观察袋体内是否有菌生长。
一次性系统细菌挑战结果见下表6:




