小核酸简介
在生物制药创新的众多前沿领域中,小核酸领域已凸显出其巨大的潜力和广阔的应用前景。小核酸药物涵盖反义寡核苷酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)以及核酸适配体(Aptamer)等,通常由12至30个核苷酸构成单链或双链结构。各类小核酸药物都有其独特的作用机制和优势,能够通过精确调控基因表达或抑制特定基因序列来实现对疾病的治疗效果[1]。近日,2024年度诺贝尔生理学或医学奖授予科学家维克托·安布罗斯和加里·鲁夫昆,以表彰他们发现了微小RNA(miRNA)及其在转录后基因调控中的作用。在众多核酸药物类型如ASO、siRNA、mRNA相继取得突破后,RNA疗法再次引起大家的广泛关注。
本文主要针对小核酸药物制备工艺及膜过滤技术的应用进行梳理介绍,以帮助大家高效解决小核酸工艺路径中所遇到的实际应用问题。
小核酸工艺——合成
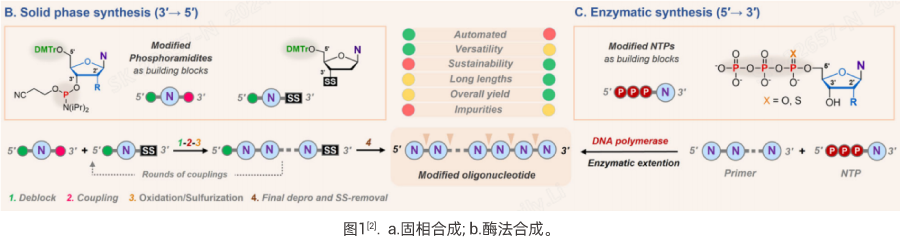
对于小核酸的合成方式主要有固相合成和生物合成法。目前主流的化学合成方法为固相亚磷酰胺法——通过合成仪在固相载体上精确控制核苷酸的添加顺序,经过多个循环合成出特定序列的小核酸,每个循环主要包括脱保护、偶联、氧化及加帽四个步骤(图1a),而整体生产工艺的关键步骤包括合成、切割与去保护、色谱纯化、超滤、退火(如:双链寡核苷酸)、冻干等[3]。这种固相合成的方式稳健且通用性强,能够高效、大规模合成短到中等长度(5-80nt)和大量修饰的寡核苷酸序列,但其受限于较短的修饰寡核苷酸序列。而基于聚合酶的生物催化法制备的核酸(图1b),对其序列长度可以没有限制,但对修饰核苷酸的位置、数量和复杂性的控制是非常有限的。
小核酸工艺——杂质去除
对于小核酸CMC的考量因素主要包括单体供应、质量控制、杂质表征、分离纯化等,其中相关杂质的分析、表征及控制策略尤为关键且更具挑战,如关于磷酰胺中杂质限度的设定,基于固相合成的迭代性质需要考虑其在合成中的引入次数所产生的累积。ICH的相关指导原则适用于寡核苷酸,其中工艺过程相关的杂质(ICH M7基因毒杂质)、无机杂质(ICH Q3D)和残留溶剂(ICH Q3C),详情可参阅相应指导原则[4]。另外,寡核苷酸安全工作组小组委员会(Subcommittee of the Oligonucleotide Safety Working Group, OSWG)也讨论了有关寡核苷酸药物的工艺过程相关(process-related)和产品相关(product-related)的杂质问题[5-6],其中工艺过程相关的有机杂质包括起始原料、配体、活化剂、封端试剂、硫化机和保护基团等,它们通常在合成过程、纯化及超滤过程中可以被去除。超滤步骤亦可有效去除原料药中的无机杂质,达到低于检测限的水平。而产品相关杂质通常为N-1、N-2、N-x(缺失或短聚物)、N+杂质、长聚物、未完全去保护的寡核苷酸、磷酸二酯杂质(P=O)等,这些杂质可在色谱纯化过程中被有效去除或降低至符合限度。历史研究数据的积累有助于证明在开发过程中的杂质去除能力,从而实现最少程度上的检测。
小核酸工艺——化学修饰与递送
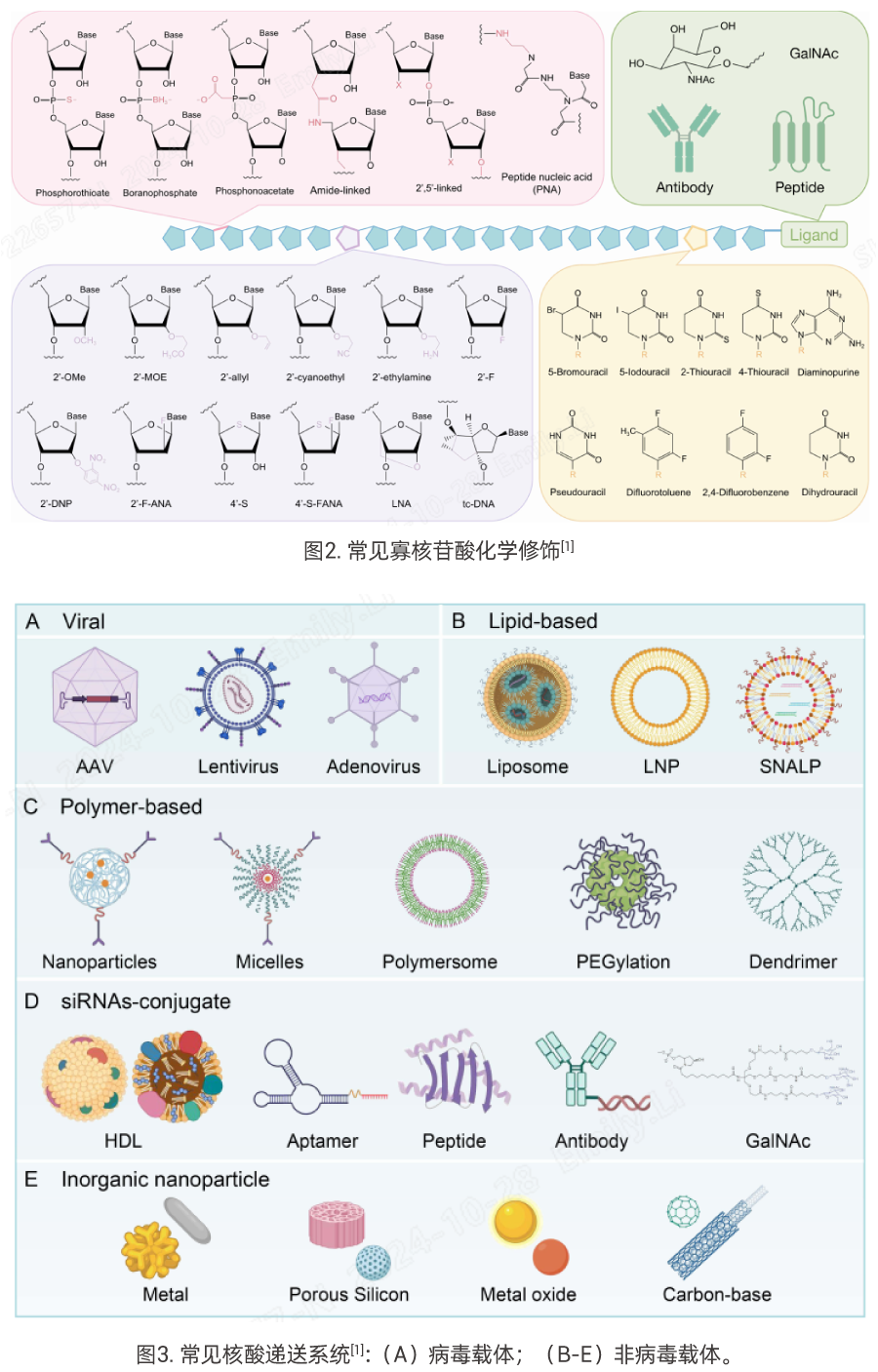
然而,在小核酸的成药问题上仍面临着如递送难题、免疫原性、脱靶效应等挑战。多年来,通过多种化学结构的修饰和递送系统的探索,其可被化学修饰的位点,包括末端、主干、核糖部分和碱基(如图2),如siRNA的硫代磷酸酯(PS)修饰、核糖的2'-F或2'-OMe修饰已广泛应用于上市siRNA,这些修饰可以提高血清稳定性,延长半衰期,增强RNAi能力,减少脱靶效应等[1]。然而,在化学修饰的基础上,对于小核酸的胞内递送,其优良的递送系统也是至关重要的,其中LNP和GalNAc(N-乙酰半乳糖胺)是目前研究和应用相对成熟的递送体系(如图3)。GalNAc的递送系统在肝脏靶向递送方面表现尤为突出,且相较于LNP,它展现了更低的免疫原性和更优的安全性。而LNP的递送系统对核酸类药物递送具有相对较高的普适性,目前也是mRNA疫苗制剂的主要递送形式。
基于以上小核酸制备及其LNP递送系统的工艺应用,科百特能够提供高效可靠的解决方案,其有关膜过滤技术的部分应用案例展示如下:
小核酸应用的膜包精度选型
· API超滤:
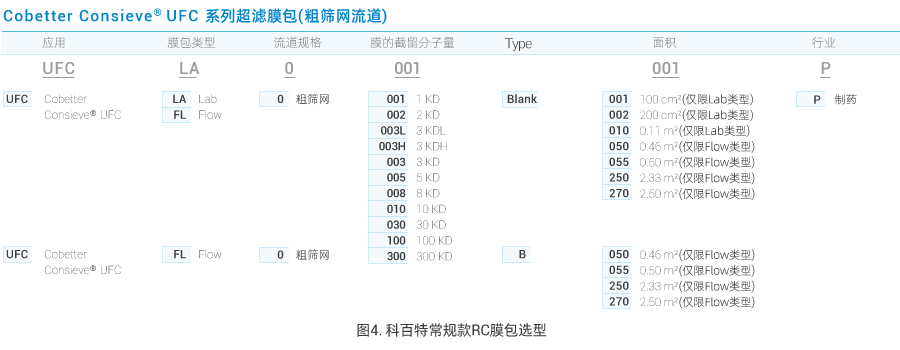
对于小核酸超滤,通常可应用3KD、3KDH(3KD高截留款)、2KD、1KD等精度,科百特具有以上多种精度、多种规格的再生纤维素RC膜包(见图4),可兼顾多序列长度及体量的API超滤除杂、脱盐换液等需求。
· API内毒素去除:
对于小核酸物料的内毒素水平控制,一方面主要依赖于厂房环境、原料、接触物料容器具等物料的无菌和内毒素水平控制,一方面也可通过超滤的形式,以30KD或50KD截留精度膜包对小核酸物料进行超滤,实现对部分内毒素聚体的有效截留,使目标小核酸产物在透过端得到收集,实现其一定程度上对内毒素水平的有效把控。另外,对于相关缓冲液溶液的内毒素控制通常可以采用6-10KD的超滤膜包实现99.99%以上的截留去除效率,也可采用科百特阴离子吸附膜Purcise Q高效、高载量的去除内毒素。
超滤工艺及案例分析
· 精度选型:
针对6KD分子量的小核酸,超滤选型同步对比科百特3KDH及2KD膜包,工艺数据如下:

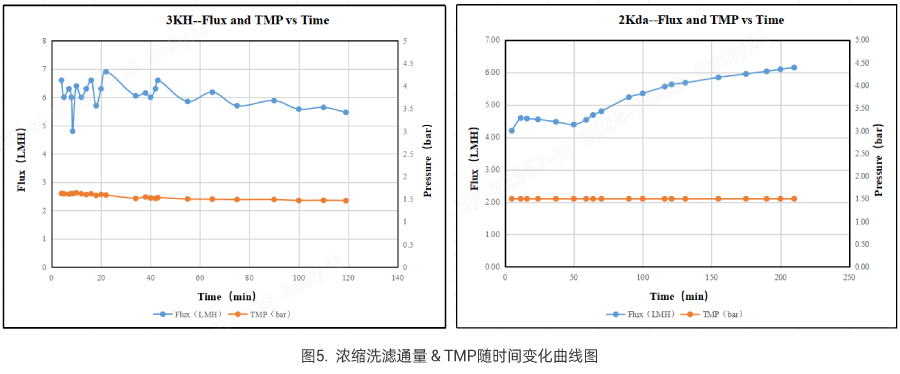
如上述数据,在均可保证该物料收率的情况下,高截留款3KDH膜包在高盐溶液中具有更高的工艺通量,相比于2KD膜包,在相同处理量所需膜面积或工艺时长上具有一定优势。结合我司评估数据经验,3KDH或2KD膜包对于常规长度或分子量6-8KD左右的不同小核酸序列均具有较高的通用性,但实际需对比测试并结合整体过滤通量、收率及工艺时长等指标进行精度优选。
· 超滤工艺:
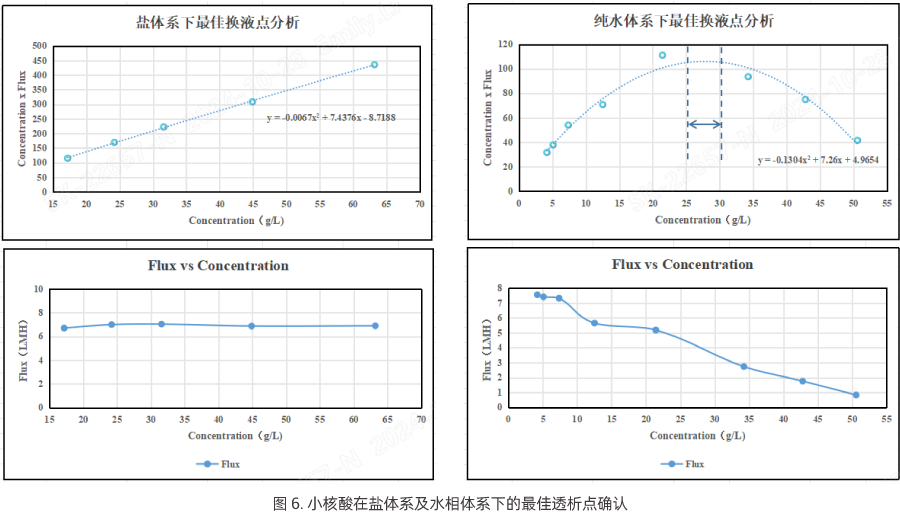
纯化后的小核酸通常含有机溶剂和盐分,需要通过透析、超滤的方式去除,而在超滤过程中因超滤膜孔径精度过小,即使在TMP相对较高的情况下,透过通量水平依然是相对较低的,这也导致超滤所需工艺时间往往很长。故此,超滤工艺过程中最佳浓缩倍数或换液时间点的确定对工艺时长影响尤为关键。
以下案例将小核酸分别在盐体系和纯水体系下进行超滤浓缩,通过实时通量及对应物料浓度的检测,来分析评估不同体系下的最佳浓缩倍数或换液时间点。
如图6可见,物料在盐体系下超滤,其膜包通量随物料浓度升高无明显衰减;而在纯水体系下其通量随浓度升高明显下降。我们主要参考纯水体系下较高通量水平时的物料浓度范围值,作为超滤工艺中的最佳浓缩浓度范围值,再进行换液步骤,则可适当减少工艺时间。