硅胶管常用于医药生产过程的物料转移,硅胶材质本身以其优越的生物相容性,在医药和医疗器械(包括植入型)领域广泛应用。随着ICH Q9 “质量风险管理”和ICH Q12“药品全生命周期管理”等法规的颁布和落实,以风险识别、分析、界定、控制和回顾为全生命周期管理起点和引擎的理念,逐渐引发了全球范围内一系列法规的更新。
风险评估
USP <665> 关于药品塑料生产组件材料及系统的药典章节,也增加了验证前风险评估的规定,基于风险高低对工艺组件进行不同程度的研究,即高风险需要更多详细深入的验证,低风险可豁免部分验证。根据其与工艺流体的接触时间、接触温度、与组件流体的相互作用程度(包括材料组成)、以及药品临床使用风险和杂质去除步骤等调整因子,其工艺风险从低风险到高风险不等。
硅胶管材料组成
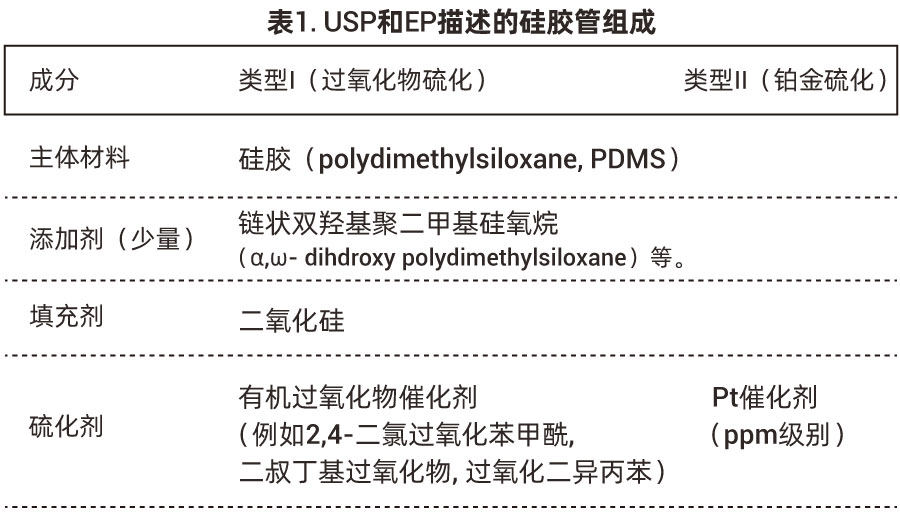
为了合理评估硅胶管的风险,深入了解硅胶管的材料组成至关重要。USP <383> “医药包装与生产组件用硫化硅胶弹性体” (2028年生效)与EP 3.1.9“硅胶弹性体密封件与管子”对医药级硅胶均有明确描述。如表1,大体可分为两类,过氧化物硫化硅胶与铂金硫化硅胶。硅胶管的主体材料PDMS的合成与硫化过程见图1所示。

相容性研究
根据2020年10月21日国家药监局药审中心发布的《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)》1指出“组件系统生产商应对所选材料的质量充分把关,避免使用有毒有害的添加剂,做到 从源头控制风险。”,这是药审中心对于质量源于设计(Quality by design, QbD)理念的重申,并提出要关注“硅橡胶低聚物成分(如D3, D4, D5, D6 环硅氧烷类)”,以及“还需关注对未知提取物质的分析和研究。” 这些要求讲硅胶管的相容性要求较2018年的弹性体相容性研究指导原则2又提高了一个层次。
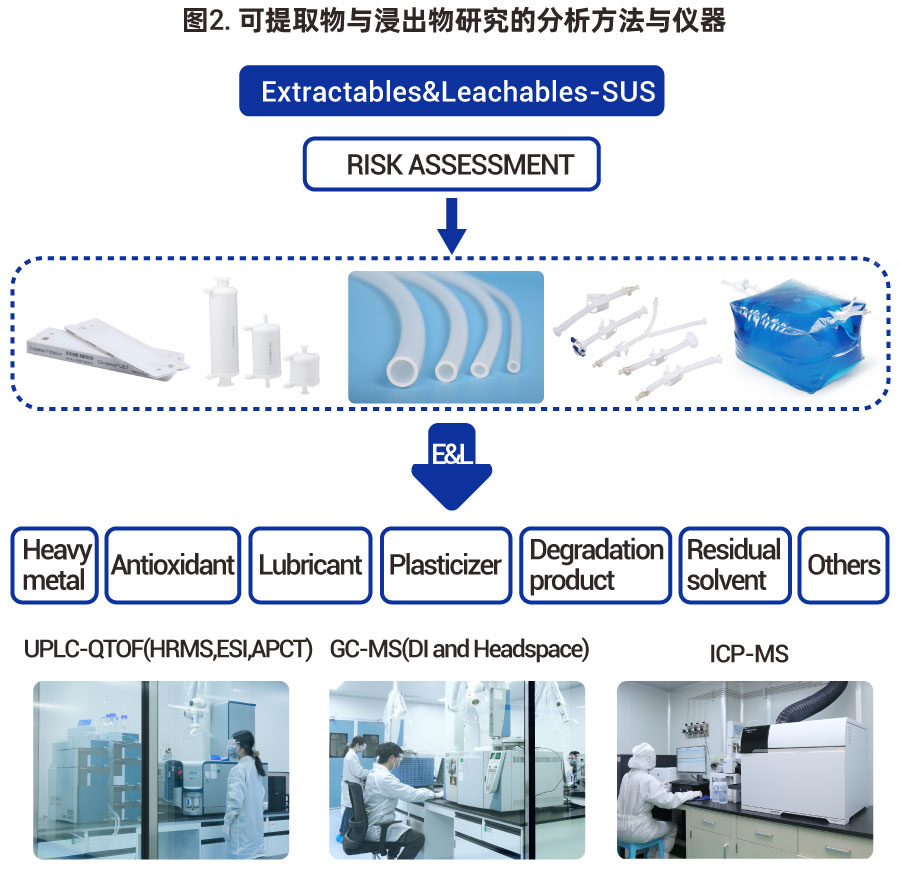
因此,为了满足新法规的要求,需要加强对未知物的解析工作。我们采用超高效液相质谱仪四级杆飞行时间质谱联用技术(Ultra-Pressure Liquid Chromatography – Quadrupole Time of Flight - Mass Spectrometer, UPLC-QTOF-MS)和气相色谱质谱联用技术(Gas Chromatography – Mass Spectrometer, GC-MS),配合先进的ChemSpider与NIST数据库和专业的分析工程师,对可提取物中的未知物二级质谱图开展解析,鉴别化合物的关键官能团或整体结构,特别是聚合物的寡聚体。
毒理学风险评估
相容性研究需要最终对可提取物谱/浸出物谱开展基于临床给药场景的安全性评估。硅胶弹性体主要由未硫化的硅胶(PDMS)、填充剂、硫化剂及其他少量添加剂在加热条件下硫化形成。以下是主要成分的基本毒理学性质。
(1)PDMS硅胶
PDMS毒性非常低。据McGregor等人研究,除了小分子的硅油组分(非聚合物,比如),对于皮下注射、肌肉注射、腹腔注射,硅油(PDMS)在实验室动物几乎不产生反应。[29]
(2)硫化剂/催化剂
过氧化物催化剂化学性质非常活泼,加热后极易分解,2,4-二氯过氧化苯甲酰降解产生的2,4-二氯苯甲酸常在硅胶管(类型I)的可提取物谱/浸出物谱(Extractables/Leachables Profiles)中被报道3-4。有一定的毒性(见下表),并且相比于铂金硫化硅胶管Pt催化剂的添加量(ppm级别)较高,出现在料液里可能影响产品的杂质谱。
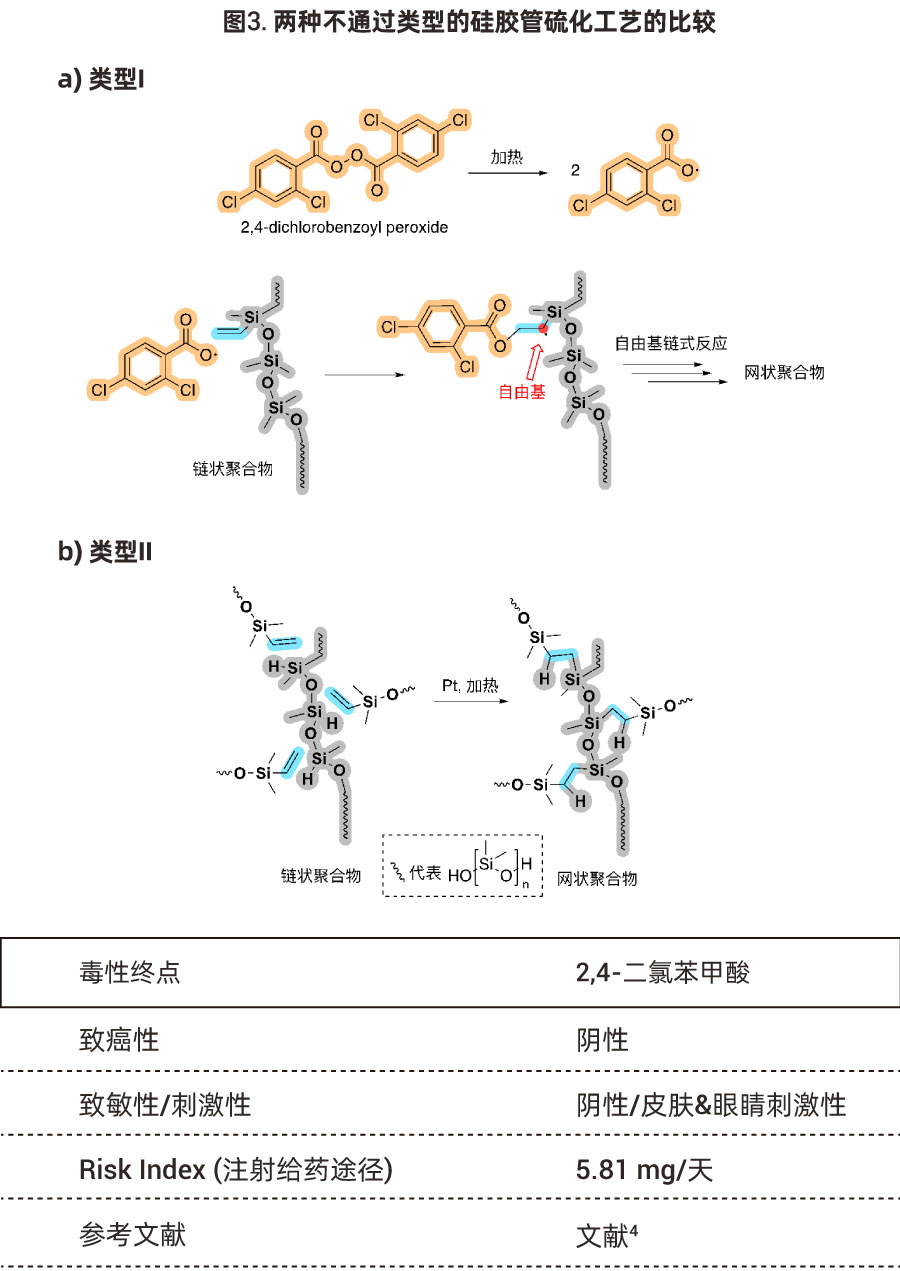
因此,从该添加剂降解产物的浸出方面讲,铂金硫化硅胶管在医药领域应用上更具优越性。
(3)硅橡胶低聚物成分
根据丹麦环境保护局,小分子硅氧烷,例如HMDS(六甲基二硅氧烷)或环状聚二甲基硅氧烷cPDMS较易挥发且脂溶性强,与大分子聚二甲基硅氧烷(PDMS)相比,毒性较强——经皮吸收、口服、注射、吸入均有致死剂量可导致动物死亡。有文献指出,D4有弱雌激素或雌激素拮抗作用,导致小鼠促黄体激素LH高峰来临推迟,可能推迟排卵24 h,降低小鼠生育率。然而,由于人类生理周期一个月左右,较小鼠生理周期长,这个毒性终点很难对人造成类似影响5-6。该研究遵守OECD TG413指导原则,对大鼠每组雄雌各20或30只分别在0、140、730、3420、13640 mg/m3的浓度下予以鼻暴露6 h/天,5天/周共3个月,随后进行1个月的恢复期。其中最低剂量组(140 mg/m3)即有小肠发炎、肺泡巨噬细胞聚集症状,因此LOAEL值为140 mg/m3。考虑到24 h人体呼吸体积28.8 m3,采用了作者建议的毒理学种属差异调整因子2.5,个体差异10和使用LOAEL的调整因子10,可得对于HDMS的吸入给药途径PDE为288 μg/天。
其它几个小分子硅氧烷的毒理学阈值见表2所示,较HDMS毒性较小。我们的硅胶管中未检出毒性较强的HDMS。

生物安全性
生物安全性是药品安全性的重要一方面,常规药品包装材料、给药系统以及药品生产系统均需要开展生物安全性方面的测试,例如USP <87> 体外生物反应性测试关于细胞毒性方面的测试等。
细胞毒性测试是非常灵敏的测试,在2022年发布的《上市药品包装变更等同性/可替代性及相容性研究指南》中指出,安全性评估是否可以豁免需要两方面的证据:1)化学等同,2)体外细胞毒性试验可接受(玻璃等无机材料除外)。而USP <87> 属于药典规定的材料符合性测试,是应用于生产药品包装系统、给药系统、以及中高风险的生产系统的最低标准。参考ISO 10993-5的细胞毒性方法和可接受标准(e.g. 70%viability以下表明存在细胞毒性),我们对科百特硅胶管开展了细胞毒性研究,表明硅胶管在四种常见的细胞体系均表现了良好的体外生物安全性。

结论
硅胶管尤其是铂金硫化硅胶管具有优良的生物相容性,在药品生产过程中广泛应用。在开展硅胶管的相容性研究中要特别关注硅橡胶低聚物成分和未知物组分,并需采用高分辨质谱技术对未知物开展结构解析,特别关注毒性较强的小分子硅氧烷类物质。在开展硅胶管可比性研究时,即使可提取物谱或浸出物谱可比,也需要参考细胞毒性试验结果判定其生物学等同性。
科百特坚持以客户为中心,致力于生命科学领域的材料开发和产品应用,依托强大的材料研发、产品设计、模具制造、注塑以及验证应用团队,提供具有行业竞争力的产品,通过优质的服务和持续创新的方案,快速的响应和产品交付,帮助客户降低系统成本,提高客户产品生产的安全性。
参考文献:



