
冻干(Lyophilization)
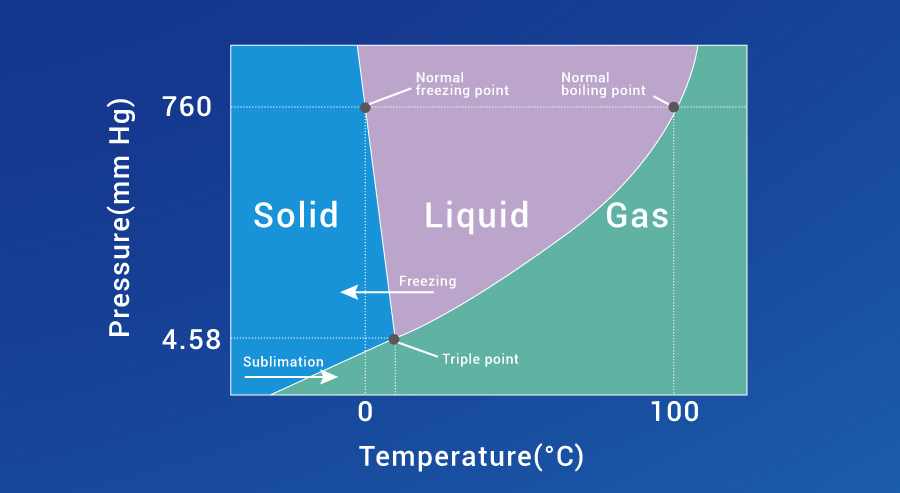
是一种通过水或其他溶剂的升华和解析将液体转化为固体的过程(见图1)。该过程包括三个相互高度关联的阶段:冷冻、一次干燥(升华)和二次干燥(解析)。
 冻干通常用于稳定在液态或冷冻状态下不稳定的活性药物成分(API)和制剂。由于冷冻干燥在低温下进行,所以该方法是对热敏感的原料药和生物制剂(如蛋白质和肽)的理想干燥方法。但在冻干工艺中,使用敞口不锈钢冻干盘在药品污染等方面受到挑战。为解决用户疑虑,科百特经研发测试,推出可替代不锈钢冻干盘的Lifecube FDT一次性冻干盘,该产品通过PP框架与e-PTFE膜的有效结合,形成完全密封的、无菌的容器。e-PTFE屏障膜在整个冻干工艺中可提供有效的保护,同时在干燥阶段可以让水和溶剂快速升华逃逸,避免了药物在冻干过程中飞溅和喷出的风险。
冻干通常用于稳定在液态或冷冻状态下不稳定的活性药物成分(API)和制剂。由于冷冻干燥在低温下进行,所以该方法是对热敏感的原料药和生物制剂(如蛋白质和肽)的理想干燥方法。但在冻干工艺中,使用敞口不锈钢冻干盘在药品污染等方面受到挑战。为解决用户疑虑,科百特经研发测试,推出可替代不锈钢冻干盘的Lifecube FDT一次性冻干盘,该产品通过PP框架与e-PTFE膜的有效结合,形成完全密封的、无菌的容器。e-PTFE屏障膜在整个冻干工艺中可提供有效的保护,同时在干燥阶段可以让水和溶剂快速升华逃逸,避免了药物在冻干过程中飞溅和喷出的风险。


产品优势
Lifecube FDT一次性冻干盘在生物制药领域可用于处理大体积、高粘度溶液,实现更均匀的干燥效果,主要优势如下:
·提升干燥效率:通过优化表面积与样品厚度的比例,缩短干燥周期;
·适应批量化生产:冻干盘能够处理更大批次的物料,同时保持产品一致性;
·快速投产:一次性冻干盘省去了反复清洗和灭菌的环节,能够快速切换批次生产;
·减少交叉污染风险:一次性材料的使用降低了清洗过程中的污染隐患,确保产品安全性;
·高兼容性:可与大部分冻干设备兼容。
产品信息
·产品容积: 200-1800mL
·推荐使用温度: -80℃~125℃
·包装方式: 双层包装
生产环境
科百特Lifecube FDT一次性冻干盘的组装检验包装均在ISO Class 4.8受控环境和洁净室完成。
产品的生产制作检验过程符合cGMP,产品100%通过光学视觉检查,以检查可见污染物与工艺缺陷;
产品在遵循 ISO®9001:2015 质量管理体系的工厂内生产。
产品性能
· 生物相容性:
USP <87> 体外生物安全性;USP <88> Class VI 体内生物安全性。
· 细菌内毒素:
Lifecube FDT 一次性冻干盘的细菌内毒素含量 < 0.125 EU/ml,其细菌内毒素水平符合中国药典规定的注射用水质量标准。
按《中国药典》2020 年版四部 通则 1143 细菌内毒素检查法(同 USP <85> BACTERIAL ENDOTOXINS TEST)凝胶法测试。
· 不溶性微粒:
Lifecube FDT 一次性冻干盘洗脱液不溶性微粒符合《中国药典》中大容量注射液要求。
按《中国药典》2020 年版四部 通则 0903 不溶性微粒检查法(同 USP <788>) 中,第一法(光阻法 )进行测试。
· 微生物屏障测试:
根据干性屏障与湿性屏障测试结果分析,Lifecube FDT 一次性冻干盘的呼吸膜可以保持无菌屏障的能力。
按《消毒技术规范》第 2.1.7.5.2 条透气性材料微生物屏障试验法来检测 Lifecube FDT 一次性冻干盘透气膜的微生物屏障。
· 泄漏测试:
Lifecube FDT 一次性冻干盘经 121 °C 高压蒸汽灭菌 30 min,累计 1 次,或伽马辐照灭菌后,仍保持良好的密封性。
Lifecube FDT一次性冻干盘,外观和尺寸检查无误后,经 121 °C 高压蒸汽灭菌 30 min,累计1次,或伽马辐照灭菌。将灭菌后的冻干盘内注满 15-25 °C 水,排除所有空气。
连接到试验装置上,压力达到 0.5 psi,检查其是否泄漏。
· 耐低温测试:
Lifecube FDT 一次性冻干盘经 - 60°C 冷冻循环 4 次后仍可以保持良好性能。
· 极限冷冻测试:
Lifecube FDT 一次性冻干盘经装入纯水 - 80°C 冷冻 7 天后仍保持良好性能。
· 长期冷冻测试:
Lifecube FDT 一次性冻干盘经装入乙腈 - 60°C 冷冻 14 天后仍保持良好性能。
· 爆破强度:
一次性冻干盘在使用过程中可能出现冻干盘内压力升高的情况,爆破强度是衡量一次性冻干盘耐高压或抗爆能力。
Lifecube FDT 一次性冻干盘爆破强度>0.3Mpa。



